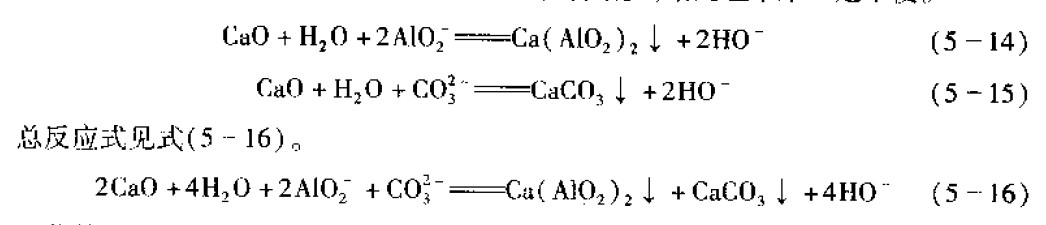蚀刻液中Al3+的清除
为了保持溶液中的Al3﹢含量在规定范围内,要定期分析并清除多余的Al3﹢,最简单的方法就是上面所讨论的排掉部分旧液,再补充新液。也可根据实际情况,采用其他方法除去溶液中多余的Al3﹢。
如果不除去溶液中多余的。Al3﹢容易导致:边缘轮廓不清晰、流线、蚀刻速度变慢及表面粗糙度增大等缺陷的发生。所以在蚀刻液中Al3﹢要保持在工艺规定的范围内,这有利于防止因大量Al3﹢的存在而引起的NaAlO3和Al(OH)3的沉淀,这些沉淀物附在槽壁及加热管上会给清理工作带来很大的麻烦。如果溶液中的Al3﹢浓度在规定范围内,同时经常保持溶液温发存50℃或以上,一般都不会发生坚硬的沉淀物生成(坚硬物的主要成分是AL2O3·3H2O)。
如果存溶液中添加部分多价金属螫台剂,可防止在较高Al3﹢浓度的情况下,丰成坚硬沉淀物,这时生成的是一种比较松软易于除去的淤泥。
当溶液中的Al3﹢浓度太高,以至于换掉部分旧液后也无法进行有效的化学蚀刻,这时的蚀刻液已成为废液,应全部换成新的蚀刻液。在槽壁和热文换器上有大量的Al2O3.3H2O和Al(OH)3附着,并随着沉淀的生成可使NaAIO3,转变成NaOH2反应式如下
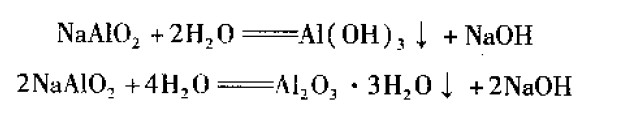
以上两反应式是非常有意义的,因为它们预示着NaOH的回收和铝的分离。如果以卜反应能进行得完全,对于大型的铝合金化学处理厂来说是很合算的,它一方面降低了污染,可以节省大量废物处理费用,同时Al2O3还可以作为商品出售。但是在实际生产中,这两个反应式进行得并不完全,只是部分的完成,并没有多大实际意义。
为了使以上反应式中自沉淀及自再生过程完全进行,很多人做过这方面的实验.比如向溶液中加人晶籽促使沉淀的进行,但收效不大,并得不到稳定的效果。到目前为止最有效的方法是向Al+浓度过高的溶液中,加入第二物质和溶液中的Al3发生反应而沉淀除去,同时使NaOH得到再生。这一方法主要有以下两种方式:
(1)以Ca(AlO2)2的形式进行回收:这种方法是向含铝量较高的溶液中加入caO水溶液,使ca2和Al2反应,生成水溶性的ca(AlO:):沉淀而被除去(见反应式(5一14)),同时释放山碱,使碱得到再生。碱性溶液由于会吸收空气中的c0:生成碳酸盐,ca2和AlO2-反应的同时,也会和溶液中co3反应生成不溶性CaCO3(见反应式5一15)).这将会使CaO用量增大,使溶液中沉淀物增多.给处理带来一定不便。回收的ca(ALO2)2既可作为阻燃剂,也可做高铝水泥的添加成分。还可用于生产水
处理剂的聚合氯化锅。,
(2)以A12(SiO3)3的形式进行回收:这一方法是崩水玻璃进行处理,当溶液中加入水玻璃后,Al3+和水玻璃反应生成不溶性AI2(SiO3)3,从溶液中沉淀分离出来,并使溶被释放碱.使碱得到再生(见反应式(5-17))。而水玻璃不会和溶液中的碳酸盐反应,这就全使溶液中的沉淀不会太多,便于清理。