金属在H2SO4中的腐蚀特性
H2SO4
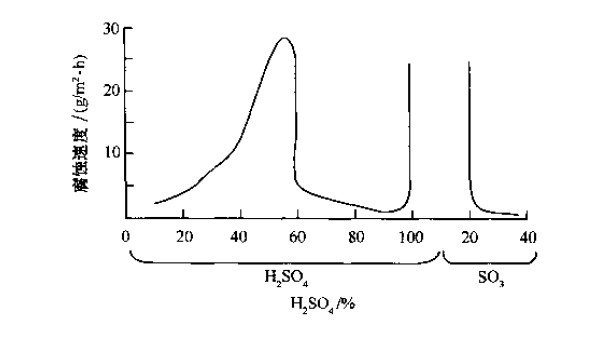
(1)铁和钢类:窀温下,随着H2SO4和发烟H2SO4浓度的增加,铁的腐蚀速率相继出现两个高峰,一个峰在稀H2SO4区,一个峰在发烟H2SO4区,如图4-3所示。
图4-3铁腐蚀速率与H2SO4和发娴H2SO4浓度的关系(室温)
在钢铁类材料的腐蚀加工中,H2SO4是一种常用的酸类。在很多腐蚀配方中,都含有较大量的H2SO4。但很少单独使用H2SO4来进行腐蚀,一般都会配合HNO3和H2PO4。H2SO4的用量一般在10%~20%左右。
Fe在稀H2SO4溶液中的腐蚀主要是析氢腐蚀,这是因为Fe的电位在氢的前面,在溶液巾H+充当了氧化剂,而S042身不发生氧化还原反应,所以铁在H2SO4巾的腐蚀过程
是一析氢腐蚀过程。其反应过程如下:
阳极反应:Fe—Fe¨+2e (4—24)
阴极反应:2H’+2e一-H+H—H, (4—25)
稀H:SO。和浓H:SO。与Fe的腐蚀反应其’}成物是不一样的,h与稀H,s0;巾的反应是一个析氢反应,并生成ns0。,其反应式如F:
H2S04+Fe—FeSO。十H2 T (4 26)
Fe在浓H:SO。中反应时,Fe能将高价硫还原来低价硫,同ⅡJ生成Fe:(SO+),,其反应式如F:
6H2S04+2n—Fe2(s0。),+6H20+.3S02 (4~27)
H:SO。对不锈钢的腐蚀性很小,绝大多数的不锈钢在常温情况下,基本上没有腐蚀现象。H:SO。在不锈钢的腐蚀中,更多的是用来为腐蚀液提供足够的H‘浓度,以部分或全部替代价格贵得多的H,P0。。但H:SO。在不锈钢的化学抛光中使用比较多。
(2)镍和镍基台金:H:SO。在室温情况F对镍及合金的腐蚀性都很小,也小单独用于对镍及合金的蚀刻,一般都是和HNO,配制蚀刻液。在20%左右H。SO。溶液中加人H:0,也能对镍进行化学蚀刻加]:。
(3)铜及铜合金:cu在稀H:SO。中腐蚀很慢,这是由于ct-的标准电极电位高ju标准氧电极电位。析氢的阴极反应不能自发进行的缘故,但cu在热的浓H,s仉或发烟H,SO。中会发生腐蚀。这是因为浓的H:SO;和发炯H:SO。有较强的氧化性。cu在热的浓H:SO,中的腐蚀反成为:
cu+H:S04一cus04十S02+2H±O (4 28)
如在稀HtSO一中添加氧化利时,则cu很容易发生腐蚀。对于铜及合金的腐蚀,在稀H:SO。中常用的氧化剂是H:O:,cu在这种腐蚀液中的腐蚀可分为两步来完成: 这种腐蚀剂在印制电路板的腐蚀加工中应用得较多,不管是蚀刻速度或是蚀刻质量,及蚀刻液的回收再生等指标都是很高的。
(4)Mg的腐蚀:Mg在H:SO。溶液中有很快的腐蚀速度,同时也足镁及合金化学蚀刻用得最多的一种腐蚀材料,Mg在H:SO。中是一种析氢腐蚀。腐蚀反应如F:
Mg+H2S04一Mgs04十H2t (4 32)
(5)zn的腐蚀:踟在H,SO一溶液中有较快的腐蚀速度,zn与H:SO。反应制取H:曾被大量使用,但是HzSO一单独用于zn的化学蚀刻并不多。zn在H:SO。中是一种析氢腐蚀.zn在H,SO.中的腐蚀反应如下:
zn十H2S04一ZnS04+H2十 (4 33)
(6)船的腐蚀:有摩温条件FH:SO。浓度低于600k,和在100℃条什下浓度小于50%,对Ag的腐蚀性很小,这是困为在地在H:SO;溶液中学成丁Ag2SO。的保护膜。但在浓H:SO。溶液中生成的A&SO。确无保护性而被腐蚀。在实际应用中,对Ag的蚀刘都不会采用H:SO。来进行,H:SO。对Ag的腐蚀用得最多的是在基底金属为铜及台金的不合格电镀她的退除上,常用的配法是用浓的H:SO。加入一定量的浓HNO,配制而成,在腐蚀时必须将零件烘干不能带入水分。
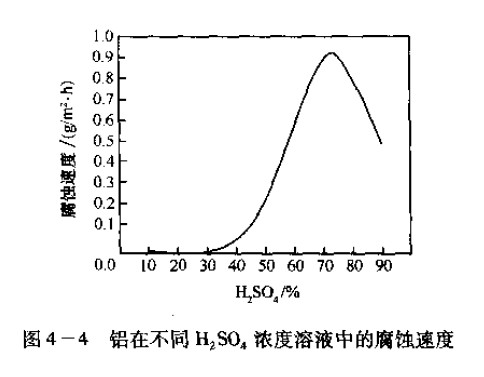
(7)Al的腐蚀:Al在稀H,SO。中腐蚀速度很慢,只有当H:SO.浓度大于40%时腐蚀速度才迅速增加。大约在80%的H:SO。中腐蚀速度达到最大位,而后随H:SO。浓度升高腐蚀速度反而减少。如图4 4所示。
H:SO。都不会单独用于铝及台金的化学蚀刻,在铝_=!耍合金中用得最多的是 采用浓H:SO。和H,PO。及HNO,组成的 化学抛光。在H:SO。溶液中加人Hcl 也町用于铝及合金的化学蚀刻。