金属的电化学腐蚀
金属的电化学腐蚀是指金属在电解质溶液中,因电化学反应而发生的腐蚀。其特点是:在腐蚀过程中同时存在_嘣个相对独立的反应过程——阳极反应和阴极反应,在反应过程中伴随有电流的产牛。金属在酸、碱、盐中的腐蚀都属于电化学腐蚀。
电化学腐蚀和化学腐蚀有着不同的机理,为了解释金属发生电化学腐蚀的原理,人们提出了腐蚀原电池模型,下面通过Cu-zn腐蚀原电池模型来加以说明(图4—1)。原电池足一个可以将化学能转变为电能的装置,丹尼尔电池是人们熟知最早的一种原电池。
将锌片和铜片分别浸入由半透膜隔开的ZnSO2和CuSO4溶液中后,再用电线把它们和电流表、负载连接起来,如图4-l(a)所示。由于锌的电势较低,铜的电势较高,它们各自在电极/溶液界而上建立的电极平衡过程遭到破坏,并在两个电极上分别进行各自的电极反应。Cu—Zn原电池电对简式如下:
(一)znIZnSO2(水溶液||cus0。(水溶液)I cu(+)
式中“l”为有两相界面存在;“||为“盐桥”。
按照电化学的定义,电极电位较低的电极称为负极,电极电位较高的电极称为正极。发生氧化反应的电极称为阳极,发生还原反应的电极称为阴极。在电化学上对电池的两个电极用阴极和阳极来命名。
由于在原电池的负极上进行的是氧化反应,其负极是阳极。正极上进行的是还原反应,其正板是阴极。因此,当用导线将网4-l(a)中的锌片、铜片、电流表和负载串接起来接通时,发现电流表的指针会立即转动。这说明有电流通过,电流方向是从铜片经导线流向锌片。锌的电极电位较低(负),铜的电极电位较高(正),在两个电极上分别进行以下的电极反应。
锌电极作为阳极,发生氧化反应:
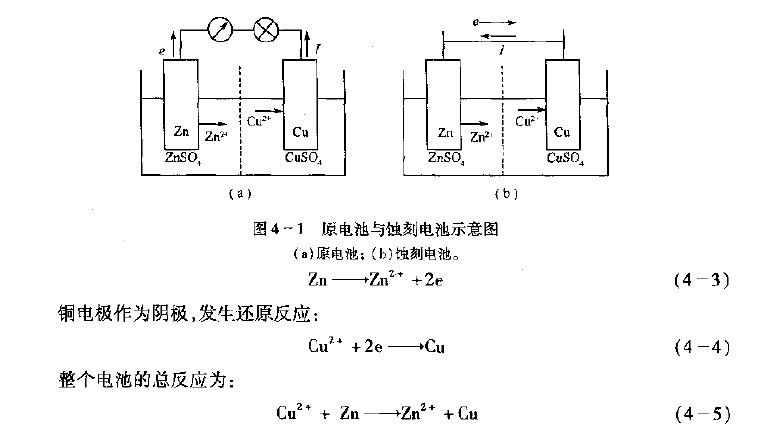
在电池工作过程中,锌电极不断发生氧化反应,锌不断被溶解,以zn2’的形式进入溶液,锌电极上积累的电子通过导线流到铜电极。铜电极上不断发生还原反应,cu。’接收从锌电极上传来的电子成为单质铜而沉积在铜片上。随着电池反应的不断进行,锌电极被氧化腐蚀而质量变小,铜电极被还原沉积而质量变大。在整个电池中,电子从锌极经导线流向铜极,在溶液中,则依靠阴、阳离子的迁移来实现电荷的传递。这样,整个电池就形成了一个回路,将化学能转变为电能为外界做功。
如果不通过负载直接把锌片和铜片如图4 l(b)用导线连接起来,这时虽然电路中仍有电流通过,但是由于电池是短路的,电池反应所释放的化学能虽然转变成了电能。但是不能对外界做功,只能以热的形式散发掉。因此短路电池已失去了原电池原有的含义,仅仅是一个进行氧化一还原反应的电化学体系。其反应的结果是作为阳极的金属材料被氧化而腐蚀。这种只能导致金属材料损失,而不能对外界做功的短路原电池称为腐蚀原
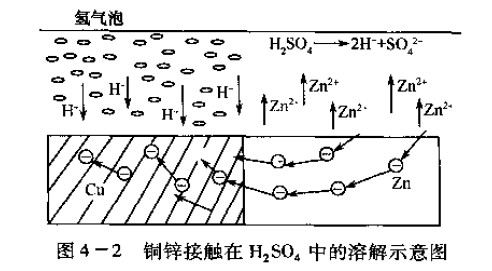
电池或腐蚀电池。而腐蚀电池才足导致金属腐蚀的根本原因所在,只是在实际腐蚀中,腐蚀电池的两电极之问并不需要导线来连接,而是两种电极的直接接触。比如将一块铜和一块锌连接再完全浸入H2so4溶液中,就组成了一个腐蚀电池。在该腐蚀电池中,锌电极电位较低,为阳极,发生氧化反应,不断溶解而被腐蚀。铜的电极电位较高,为阴极,溶液L}『的氢离子发生还原反应,在铜电极上不断有氢气析出。如图4—2所示。