Cucl3溶液成分及操作条件对蚀刻速度的影响
(1)蚀刻液中cl-浓度对蚀刻速度的影响:在酸性CuCl2蚀刻液中,cu2和cu+都是以络离子状态存在于蚀刻液中。铜由于具有不完伞的d-轨道电子壳,所以它足一个很好的络合物形成体。一般情况下,可形成四个配位键。当蚀刻液中含有大量的cl-时,cu2+是以四氯络铜([CuCl4]2)的形式存在.cu2足以三氯络铜([cucl3]2)的形式存牲。凶此蚀刻液的配制和再生都需要大量的cl参与反麻。同时cl浓度对蚀刻速度同样有直接关系,c1浓度高有利于各种铜络离子的形成,加速了蚀刻过程。
cl-浓度对蚀刻速度的影响如图5-14所示。从图5-14中可出,当盐酸浓度升高时,蚀刻时间减少。在含有6mol盐酸的蚀刻液中蚀刻速度是在水溶液巾的三倍,并且还能提高溶铜量。但是盐酸浓度不可超过6mol。高于6mol的盐酸浓度随酸度增加。由于同离子效应,使CuCI2溶解度迅速降低,同时高酸度的蚀刻液也会造成对设备腐蚀性增大。
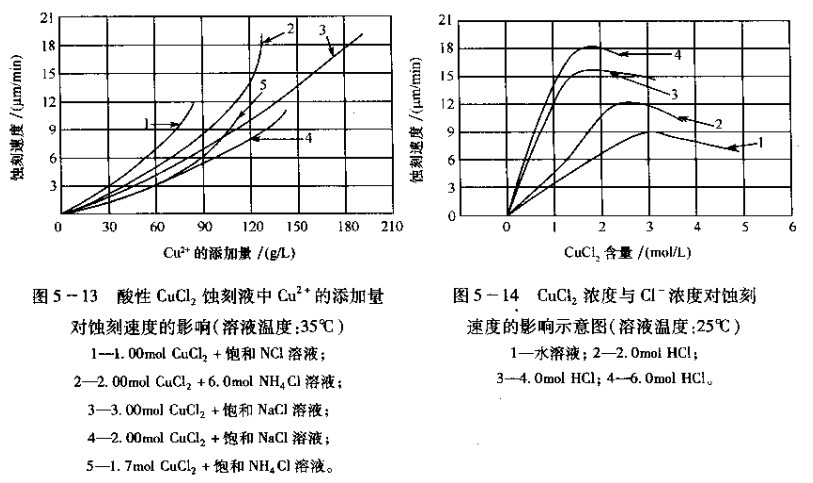
添加CL可以提高蚀刻速度的原因足:在cucL2溶液中发牛铜的蚀刻反应时,生成的cu2c12不易溶于水.则在铜的表面形成一层cucl膜,这种膜能阻止蚀刻过程的进一步进行。这时过量的cl能与cu2cL2络台形成可溶性的[cucl3]2-从铜的表而溶解下求,从而提高了蚀刻速度。
(2)cu+含量对蚀刻速度的影响:随着蚀刻过程的进行,溶液中Cu+浓度会逐渐增大。少量的Cu+就能明显减慢蚀刻速度。如在每升120g cu2+蚀刻液中有4gcu+就会显著降低蚀刻速度。所以在蚀刻过程中要保持cu+的含量在一个较低的浓度范围内。并要尽呵能快地使cu。氧化成cu“,也正凶为这样,才使得酸性cucl:的蚀刻液的普遍使用受到一定跟制。
在生产实践中控制cu‘裱度,如采作邋常使用的化学分析法,显然对于蚀刻液中cu’低浓度的严格控制是难于做到的,但通进电位拄制法就很容易解决。根据条思特方程式
E=E.+(O 059/n)1就cu“‘】/[cu’】
式中:£为指定浓度下的电极电位;E。为标准电极电位;n为得失电子数;[cu‘’】为二价铜离子浓度;[cu‘]为亚铜离子浓度。
从以卜方程可以看出,氧化一还原电位E与[cu“]/[cu’]的比值有J)∈。图5—15表明溶液中cu’浓度与氧化一还原电位之问的相互关系。
从图5一15中可以看出,随着溶液中cu‘浓度的不断升高,氧化一还原电位不断下

