酸性CuCl2蚀刻原理及组成
酸性CuCl2蚀刻方法相对于Fecl2蚀刻方法,溶铜量较大,蚀刻速度易于控制,蚀刻液
容易再生与回收,对环境污染少。对抗蚀层适应范同相同。
酸性CuCl2蚀刻液主要由CuCl2、NaCL和NH4CL等组成。在这种蚀刻液中,由于CuCL2中的Cu2具有氧化性,将零件表面的铜氧化成Cu+.Cu+和CL-结合成Cu2Cl2,其反应如下:
Cu+CuCl2一CulCl2 (5—50)
生成的Cu2cl2小溶于水,在有过最CL存在的情况下,这种不溶于水的Cu2cl2和过量的Cl形成络合离子脱离被蚀刻铜表面,使蚀刻过程进行完全。其反应式如下:
Cu2cL2+4CL-=2[cucl3]2- (5—51)
随着铜的蚀刻,蚀刻液中的cu+越来越多,蚀刻能力很快就会下降,以至最后失去蚀刻效能。为_了保持蚀刻液的蚀刻能力,可以通过多种方式对蚀刻液进行再牛,使cu4重新氧化为cu2+蚀刻液得到再生。
这种蚀刻液的配方周内外有多种,国外一些资料中介绍的几种常用的酸性cucl2蚀刻液配方列于表5—10。
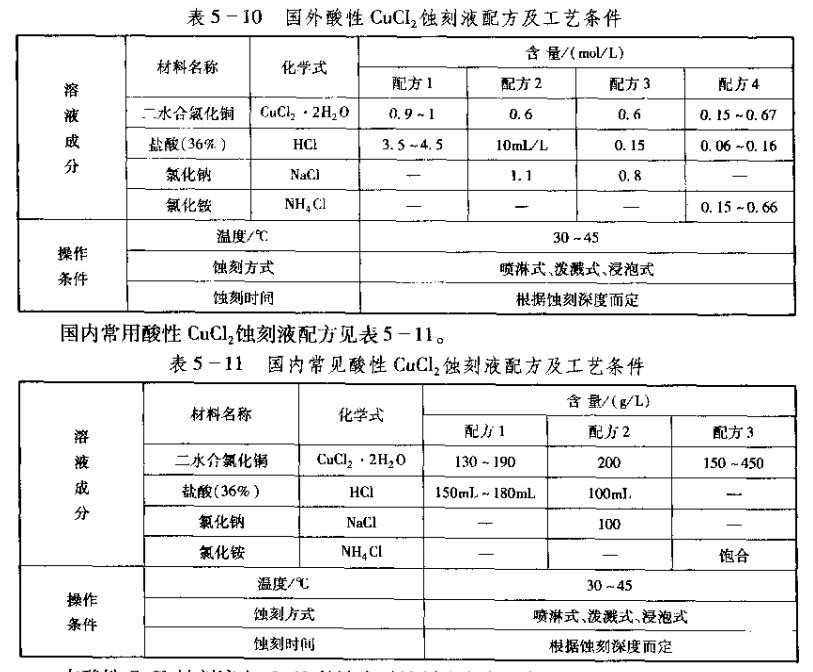
在酸性CaCl2蚀刻液中,CuCl3的浓度对蚀到速度有很大的影响,并和蚀刻掖组成有很大关系。
在酸性CuCIz蚀刻液中,Cu2+浓度及与之相配合的氯化物对蚀刻速度的影响如图5—13所币。
从图5 -3巾可以看出,存一个较宽的溶铜范围内,添加NH4CL溶液,蚀刻速度较快,这与铵能与铜生成铜铵络离子有很关系。但是这种溶液随着温度的降低,溶液中会有一些铜铵氯化物结晶(CuCI2·2NH4cL)沉淀。向添加NaCI溶液.蚀刻速度接近添加盐酸溶液的蚀刻速度,因此通常在喷淋蚀刻中多选用盐酸和NaCI这两种氯化物。但是在使用NaCI时,随着蚀刻的进行,溶液PH值会增高,导致溶液叶中CuCL2的水解变混浊,在这种蚀刻液中维持定的酸度是很重要的。

